Dank des medizinischen und wissenschaftlichen Fortschritts der letzten Jahrzehnte leben viele Menschen mit Krebs länger als je zuvor. Dies ist möglich, weil sich die Behandlungen ständig weiterentwickeln und jede wissenschaftliche Entdeckung Wege für effektivere und gezieltere Therapien eröffnet, die den Fortschritt in der Krebsbehandlung weiter vorantreiben.
Frühe Ansätze zur Krebsbehandlung sind seit Jahrhunderten dokumentiert, wobei chirurgische Eingriffe und Hormontherapie zu den frühesten aufgezeichneten Methoden gehören.1 Darauf folgte die Einführung der Strahlentherapie im späten 19. Jahrhundert und der Chemotherapie in den 1940er Jahren.1 Traditionelle Behandlungen wie Chemotherapie und Strahlentherapiewirken schnell, betreffen jedoch sowohl Krebszellen als auch gesundes Gewebe. Infolgedessen sind gezieltere Krebstherapien erforderlich, um Krebszellen gezielt zu bekämpfen und gleichzeitig das Risiko einer Schädigung des gesunden Gewebes zu verringern, um die Wahrscheinlichkeit günstiger Behandlungsergebnisse zu erhöhen.
Bei Daiichi Sankyo Europe konzentrieren wir uns auf die Antikörper-Wirkstoff-Konjugat-Technologie (ADC- Technologie), eine Therapie, die Medikamente direkt an Tumorzellen liefert.
Weiterentwicklung der modernen ADC-Technologie
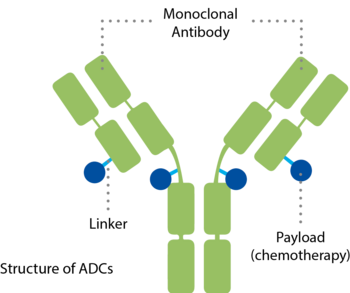
ADCs zielen auf tumorspezifische Antigene ab und ermöglichen so eine präzisere Abgabe von Arzneistoffen direkt an Krebszellen. Dank dieses Ansatzes bieten ADCs die Möglichkeit, gezielt auf Krebszellen zu wirken, während gesunde Zellen und Gewebe weniger beeinträchtigt werden.
ADCs kombinieren einen spezifischen Antikörper und einen potenten zytotoxischen Wirkstoff (Payload) in einem einzigen Molekül.5,6 Sie bestehen aus drei zentralen Komponenten:
- Ein Antikörper, der an ein spezifisches Zielmolekül bindet, das auf der Oberfläche von Krebszellen zu finden ist – ein Mechanismus, der mit einem Schlüssel vergleichbar ist, der nur in ein bestimmtes Schloss passt.
- Ein zytotoxischen Arzneistoff, auch zytotoxische Payload genannt, mit der Fähigkeit, die Krebszelle abzutöten
- Und ein Linker, der Antikörper und Wirkstoff miteinander verbindet und dafür sorgt, dass der Wirkstoff erst in der Krebszelle freigesetzt wird.
Jeder dieser drei Komponenten spielt eine entscheidende Rolle bei der Verabreichung und Wirksamkeit. 2,3,4
Die Geschichte der ADCs
ADCs haben eine lange Geschichte, die bis in die frühen 1900er Jahre zurückreicht, als Paul Ehrlich zum ersten Mal das Konzept der gezielten Wirkstoffverabreichung vorschlug.3 Es dauerte jedoch bis in die 1960er Jahre, bis die ersten dokumentierten In-vitro-Studien zur Erforschung von ADCs stattfanden.7 In den 1980er Jahren machte der Bereich erhebliche Fortschritte, und im Jahr 2000 genehmigte die US-amerikanische Food and Drug Administration (FDA) den ersten ADC zur Behandlung von akuter myeloischer Leukämie (AML). Obwohl es im Jahr 2010 aufgrund von Toxizitätsbedenken zunächst zurückgezogen wurde, erfolgte 2017 die erneute Zulassung mit angepasster Dosierung.8 Seitdem hat sich die ADC-Landschaft rasant weiterentwickelt: Im Jahr 2024 wurden weltweit 14 ADCs zugelassen und es laufen derzeit über 150 klinische Studien, die eine neue Ära in der gezielten Krebstherapie einläuten.9
Die Zukunft der ADCs
Das Interesse und der Optimismus rund um ADCs zeigen sich am Anstieg der klinischen Studien, die von 50 im Jahr 2013 auf fast 300 allein im Jahr 2023 gestiegen sind. Derzeit sind weltweit 14 ADCs für verschiedenen Krebsindikationen zugelassen, 17 befinden sich in Phase-3-Studienund drei in Phase-4-Studien.10,11
Bei Daiichi Sankyo Europe blicken wir in eine Zukunft, in der wir neue Möglichkeiten zur Krebsbehandlung entdecken, unsere Präzisionstechnologien weiterentwickeln und neue Ansätze speziell für Antikörper-Wirkstoff-Konjugate (ADCs) entwickeln. Unser Ziel ist es, Patient:innen ADCs in früheren Behandlungsphasen zugänglich zu machen.
Wir engagieren uns für die Weiterentwicklung der ADC-Technologie und nutzen unsere besondere Ausgangslage, um Herausforderungen anzugehen und das volle Potenzial dieser innovativen Krebsbehandlung auszuschöpfen.
Forschung und Entwicklung in der Onkologie
Daiichi Sankyo Europe hat es sich zur Aufgabe gemacht, innovative Therapien für Patient:innen zu erforschen und zu entwickeln. Unser europäischer Hauptsitz in München, Deutschland, dient als Drehscheibe für wichtige Aktivitäten, die sich über mehrere Standorte erstrecken.
Das Produktions- und Forschungszentrum Pfaffenhofen

Unsere hochmodernen Produktionsanlagen in Pfaffenhofen, Deutschland, dienen als wichtiger Fertigungs- und Vertriebsstandort und beliefern über 50 Länder weltweit mit Produkten. Bis 2030 planen wir Investitionen in Höhe von rund 1 Milliarde Euro, um Pfaffenhofen zu einem globalen Innovationszentrum auszubauen und damit unser Engagement für die Förderung der pharmazeutischen Entwicklung und Herstellung in Europa zu verstärken.
Die Forschung an menschlichem Gewebe gewinnt zunehmend an Bedeutung, um zu verstehen, wie der menschliche Körper die Wirkung neuer Medikamente verarbeitet. Unser Translational Research Center Europe in Martinsried bei München steht an vorderster Front dieser Forschung und hilft uns, Behandlungsoptionen mit weniger Nebenwirkungen zu finden.
Lesen Sie mehr über unser Translational Research Center Europe
Referenzen
- American Cancer Society. The History of Cancer [Accessed May 2025]
- Cheng-Sánchez I, et al. Marine Drugs. 2022;20(8)
- Fu Z, et al. Signal Transduct Target Ther. 2022;7(1)
- Conilh L, et al., J. Hematol. Oncol. 2023;16(3)
- Trail P.A, et al. Pharmacol Ther. 2018 ;181
- Tsuchikama K, An Z. Protein Cell. 2018;9(1)
- Sau S, et al. Drug Discovery Today. 2017;22(10)
- Liu K, et al. Molecular Cancer. 2024:23(62)
- Dreps A. Applied Clinical trials. 2024
- Tsuchikama K, et al. Nature Reviews Clinical Oncology. 2024;21(203-223)
- Shastry M, et al. ASCO Educational Book. 2023;43


